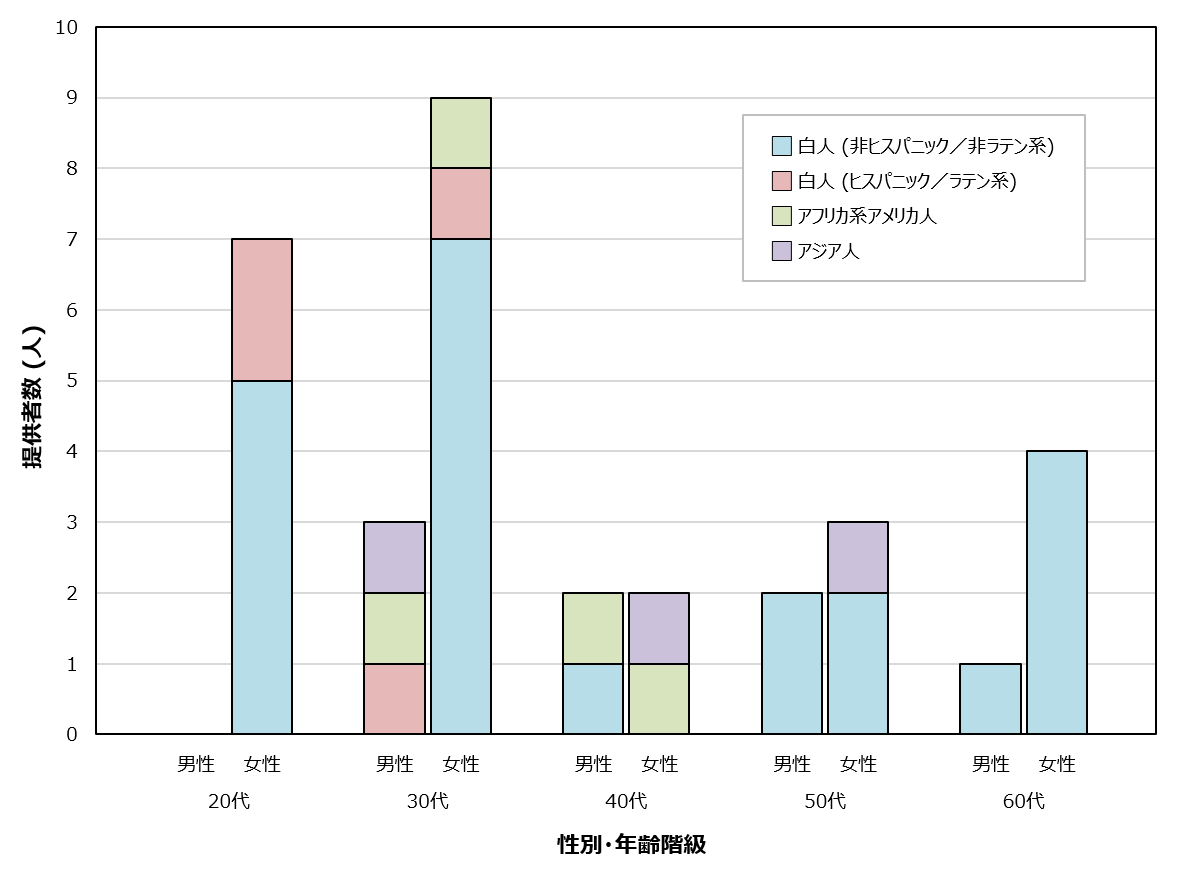背景と概要
2019年12月に中国で最初に確認された新型コロナウイルス(SARS-CoV-2)による感染症(COVID-19)は、世界の至るところで独自の変異を繰り返しながら猛威を振るってきました。一時的にはパンデミック収束の兆しが見えつつあったものの、未だ予断を許さない状況にあるといえます。2022年1月から世界的な流行をみせているオミクロン変異株は、重症化のリスクは比較的少ないとされています。その反面、感染力は強く、感染者数が爆発的に増大したことで、結果的には重症化率の高かったデルタ株の流行期を上回る死亡者が発生しています。オミクロン株は現在も変異を続け、その子孫系統は300種類以上にのぼると言われています。
COVID-19のパンデミックが甚大な被害をもたらした一方で、その克服に向けた治療薬や予防薬の研究開発はこれまでにない驚異的なスピードで進められました。その一つがワクチンです。とりわけmRNAワクチンの技術革新と迅速な実用化に繋がりました。中国の研究機関がSARS-CoV-2のゲノム配列を解読しデータを公表したのが2020年1月13日、その1か月余り後の2月24日には米モデルナ社が設計したmRNAワクチンの治験薬の最初のロットが出荷されました。そして同年の12月には、米食品医薬品局(FDA)の緊急使用許可(EUA)を取得し、アメリカでの接種が開始されました。米ファイザー社と独ビオンテック社が共同で開発したmRNAワクチンも、モデルナ社のワクチンに少し先駆ける形でFDAのEUAを取得しています。我が国においては、ファイザー/ビオンテック社製mRNAワクチン「コミナティ」が2021年2月に承認され、つづいて同5月には、モデルナ社製mRNAワクチン「スパイクバックス」と英アストラゼネカ社製のウイルスベクターワクチン「バキスゼブリア」が承認されました。日本ではその後、米ノババックス社が開発し武田薬品工業が製造・供給する組換えタンパク質ワクチン「ヌバキソビッド」(2022年4月)と、米ジョンソン・エンド・ジョンソン社の医薬品部門ヤンセンファーマ社が開発したウイルスベクターワクチン「ジェコビデン」(同6月)が承認されていますが、公的接種で使用されているワクチンは、「コミナティ」「スパイクバックス」「ヌバキソビッド」の3種類です。現在ではオミクロン株に対応したmRNAワクチンも開発、承認され、接種が進められています。
ワクチン接種は、体内に異物を投与することで免疫反応を誘導し、感染症に対する免疫を付与することを目的として行われます。上に挙げたワクチンはいずれも、SARS-CoV-2の表面に存在するスパイク(S)タンパク質(ヒトの細胞に侵入するために必要なタンパク質、解説1参照)の遺伝子あるいはその遺伝子をもとに作られた組換えタンパク質を有効成分としています。これらのワクチンを接種することにより、Sタンパク質に対する抗体の産生が誘導され、細胞へのウイルス感染を阻害する効果が期待できます。しかし、そのような有益な効果の反面で、様々な副反応が生じることがあります。接種部位の痛み、手足のしびれ、発熱、頭痛などの症状のほか、治療を要する副反応や障害が残るほど重篤な副反応が生じる可能性もゼロではありません。mRNAワクチンによる重症化予防効果は期待できることがこれまでに分かってきましたが、接種後の体内動態や接種によって引き起こされる体内応答に関する知見は、ワクチンの安全性や副反応のリスクを評価する上では必ずしも十分とは言い切れません。
福島医薬品関連産業支援拠点化事業(福島事業)では、独自開発の「タンパク質マイクロアレイシステム」を活用し、COVID-19の克服に寄与するための研究開発に取り組んできました。福島事業では、1枚のスライドガラス基板上に数千から数万個のタンパク質試料が固定化されている複数のタンパク質マイクロアレイを用いています。そこには、2万種類を超えるヒトのタンパク質をはじめ、病原体や腸内細菌など微生物由来のタンパク質が4千種類以上、花粉、昆虫、食品といったアレルゲンが1千種類以上含まれます。SARS-CoV-2由来の試料もSタンパク質を中心に豊富に揃っており、その数は250種類を超えています。Sタンパク質は、全長配列からなる試料だけでなく、S1サブユニット、S2サブユニット、宿主細胞の受容体に結合する領域(RBD)など部分配列のみからなる試料のほか、祖先株にくわえ、アルファ、ベータ、ガンマ、デルタ、オミクロンなど様々な変異株にも対応しています。また、SARS(重症急性呼吸器症候群)コロナウイウスやMERS(中東呼吸器症候群)コロナウイルス、一般的な風邪の原因として知られるヒトコロナウイルス、ウシやニワトリといったヒト以外の動物に感染するコロナウイルスなど、SARS-CoV-2以外のコロナウイルスに由来するタンパク質試料も多数固定化されています。このタンパク質マイクロアレイに、SARS-CoV-2の自然感染者やワクチン接種者の血液検体を反応させ、検体に含まれる抗体の種類や反応性のプロファイリングを実施し、データを積み重ねてきました。さらにこの技術を最大限に応用して、COVID-19から回復された患者ボランティアの皆様より提供を受けた血液検体をもとに、SARS-CoV-2を中和しうる複数の抗体の遺伝子を取得することに成功しました。
本稿では、福島事業のタンパク質マイクロアレイシステムを使って取得されたSARS-CoV-2のmRNAワクチン接種者におけるワクチン接種前後の血液中抗体プロファイリングの結果について紹介するとともに、解析の生データを公開いたします。SARS-CoV-2のmRNAワクチンの接種によって引き起こされる免疫応答について、ワクチンの標的であるSタンパク質に対する抗体の産生誘導だけでなく、自己のタンパク質(自己抗原)を含めた標的以外の多種多様な抗原に対する交差免疫の有無あるいは増減をご覧になることができます。SARS-CoV-2の自然感染回復者やCOVID-19パンデミック以前に採血した健常者(非感染者)のデータとあわせてご参照ください。
検体について
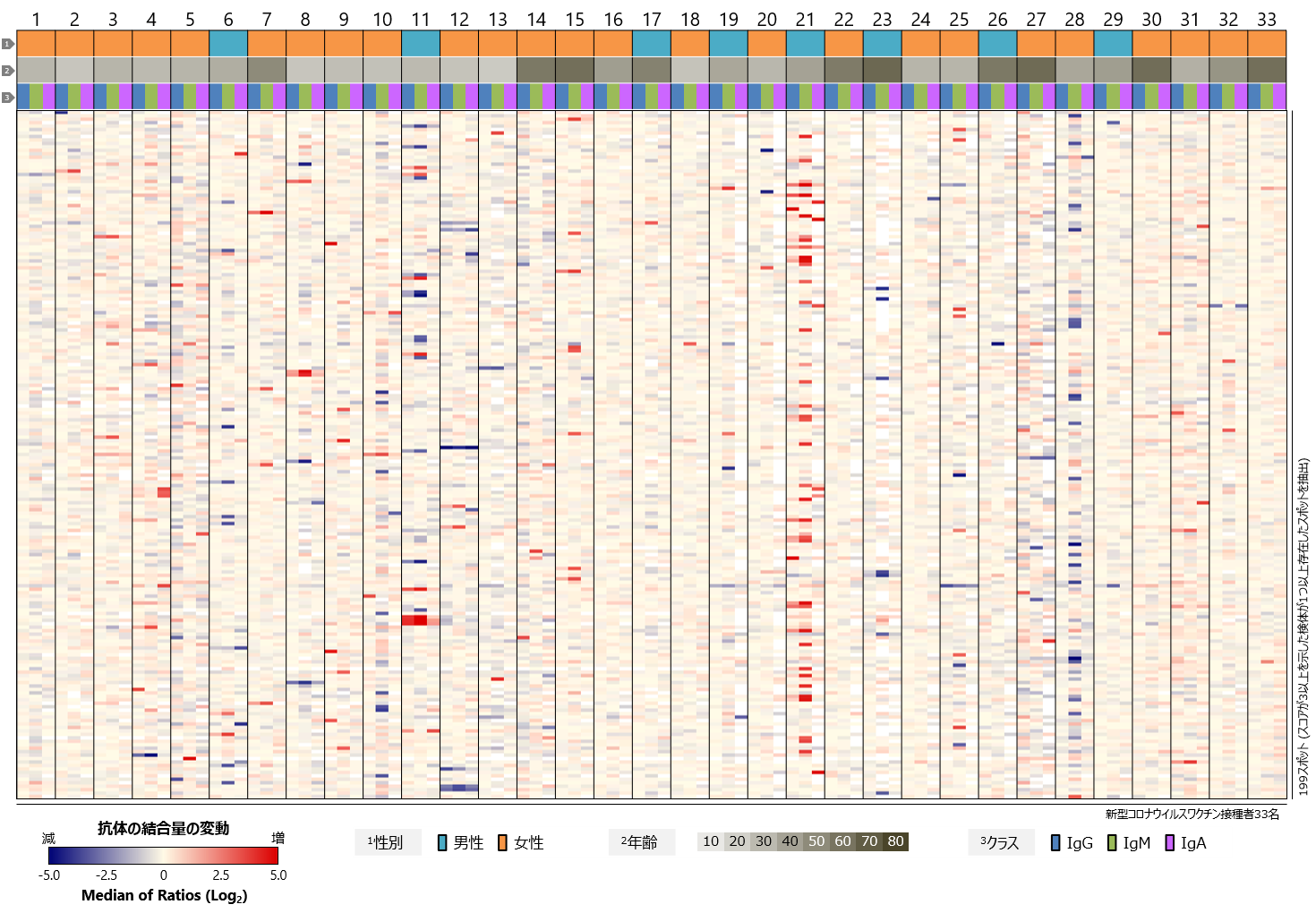
ファイザー/ビオンテック社製またはモデルナ社製のmRNAワクチンを接種した20代から60代の計33名のドナーについて、ワクチン接種前および初回接種(1・2回目接種)から一定期間経過した後に採取された血液検体を、海外(米国)のベンダーより入手しました(図1)。インフォームドコンセントが得られており、解析データを自由に使うことができます。各検体には、ワクチンの種類、接種日、採血日のほか、年齢、性別、身体的所見、接種後の副反応、基礎疾患、喫煙歴などの臨床情報が付随しています。33名のうち、8名(24%)が男性、25名(76%)が女性で、平均年齢は40.5歳です。また、被験者の多くは、非ヒスパニック/非ラテン系の白人となっています。オミクロン株流行以前に採取された検体であるため、接種に使用されているワクチンはすべて従来型の1価ワクチンです。
図をクリックすると拡大表示します
図1 検体提供者(ワクチン接種者)の内訳
■ 検体情報(以下のボタンからダウンロードできます)
結果と考察
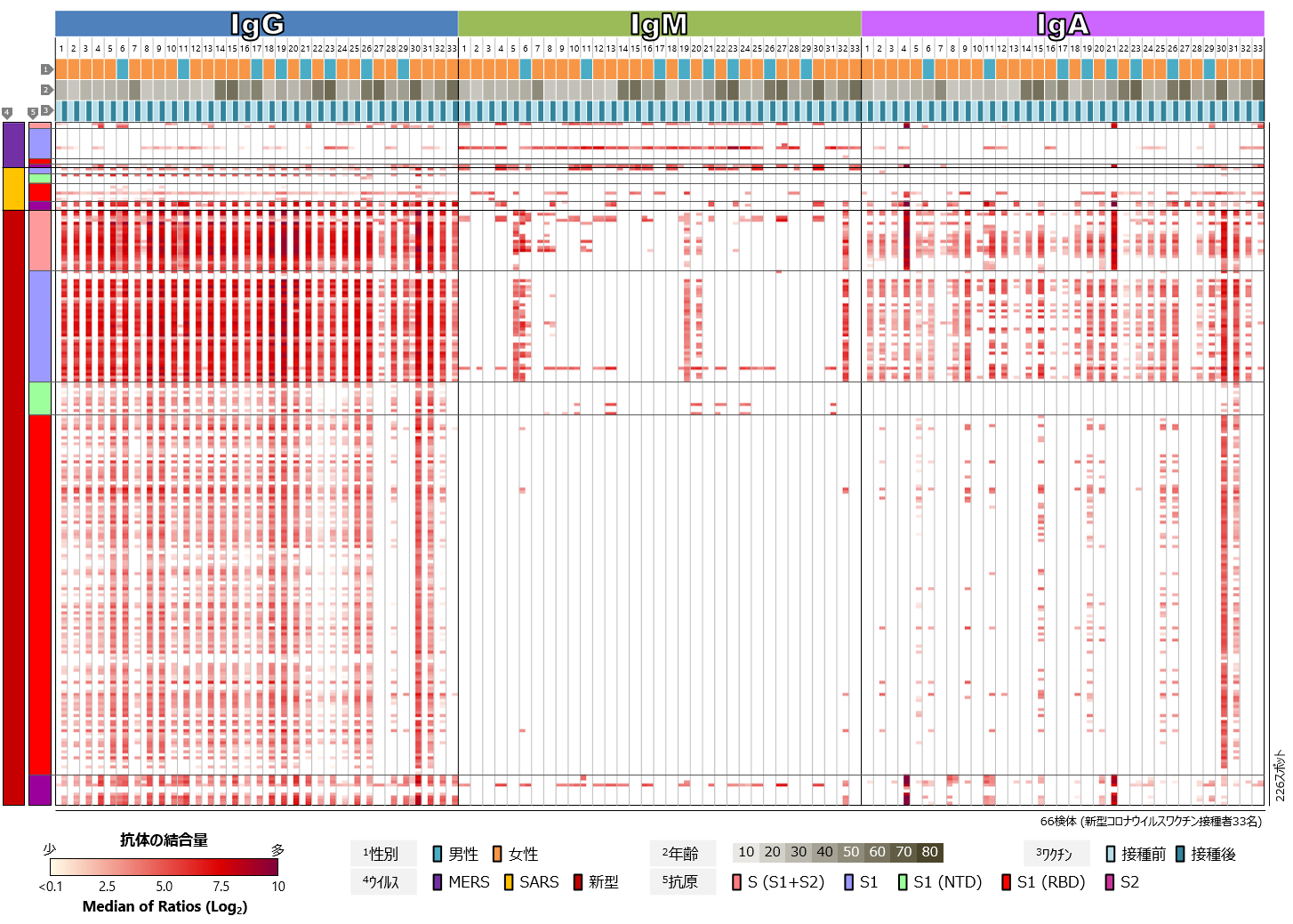
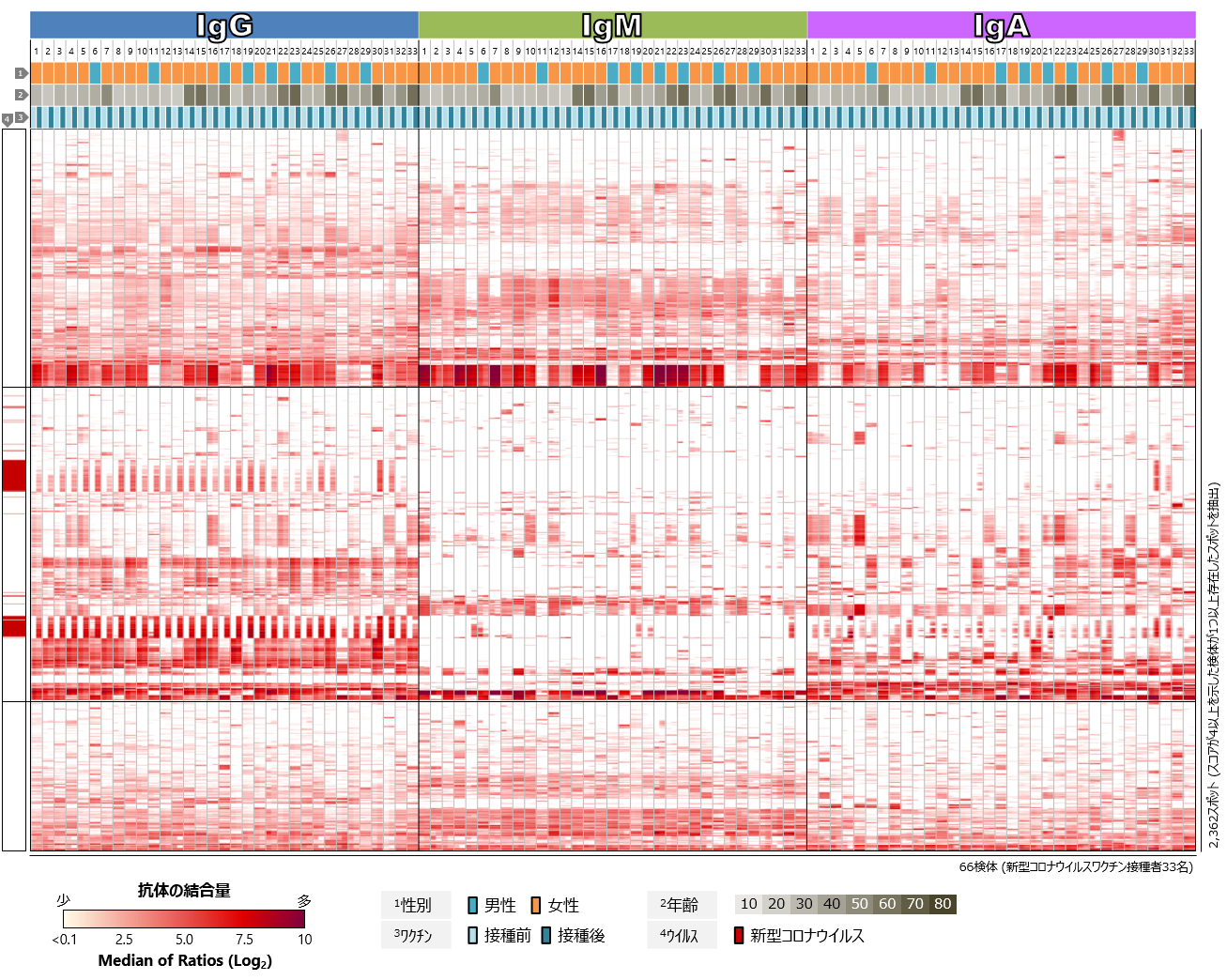
COVID-19の従来型mRNAワクチンを接種した33名について、まず、新型コロナウイルス、SARSコロナウイルス、MERSコロナウイルスのSタンパク質に対するワクチン接種前後の血中抗体プロファイルを比較しました(図2)。新型コロナウイルスのSタンパク質に対する反応に注目すると、ほぼすべての検体において、ワクチン接種後にIgGの反応が顕著に認められました。IgMについては、多くの検体で接種後でもほぼ反応が検出されませんでした。教科書的には、免疫応答において最も早期に出現する抗体がIgMであり、その後IgGやIgAへのクラススイッチが起きて、IgMは短期間で消失します(解説2参照)。接種後の検体の多くが、初回接種から2か月またはそれ以上経過した後に採取されたものであるため、ワクチンの有効成分に反応してIgM抗体の産生が誘導された後、クラススイッチが進み、IgMが消失と考えられます。一方、IgAについては、多くの検体でワクチン接種後の反応が検出されましたが、IgGに比べるとその反応は弱く、とくにRBDに対する反応が少ない傾向にありました。SARSコロナウイルスやMERSコロナウイルスのSタンパク質に対しても抗体反応の増強が認められますが、ワクチン接種によって産生された抗体の交差反応によるものと考えられます。また、年齢や性別、人種的背景によるSタンパク質に対する抗体反応の傾向の違いは、今回の解析では認められませんでした。
図をクリックすると拡大表示します
図2 新型コロナウイルスワクチン接種者における
コロナウイルスSタンパク質に対する血中抗体プロファイル
■ 解析数値データ(以下のボタンからダウンロードできます)
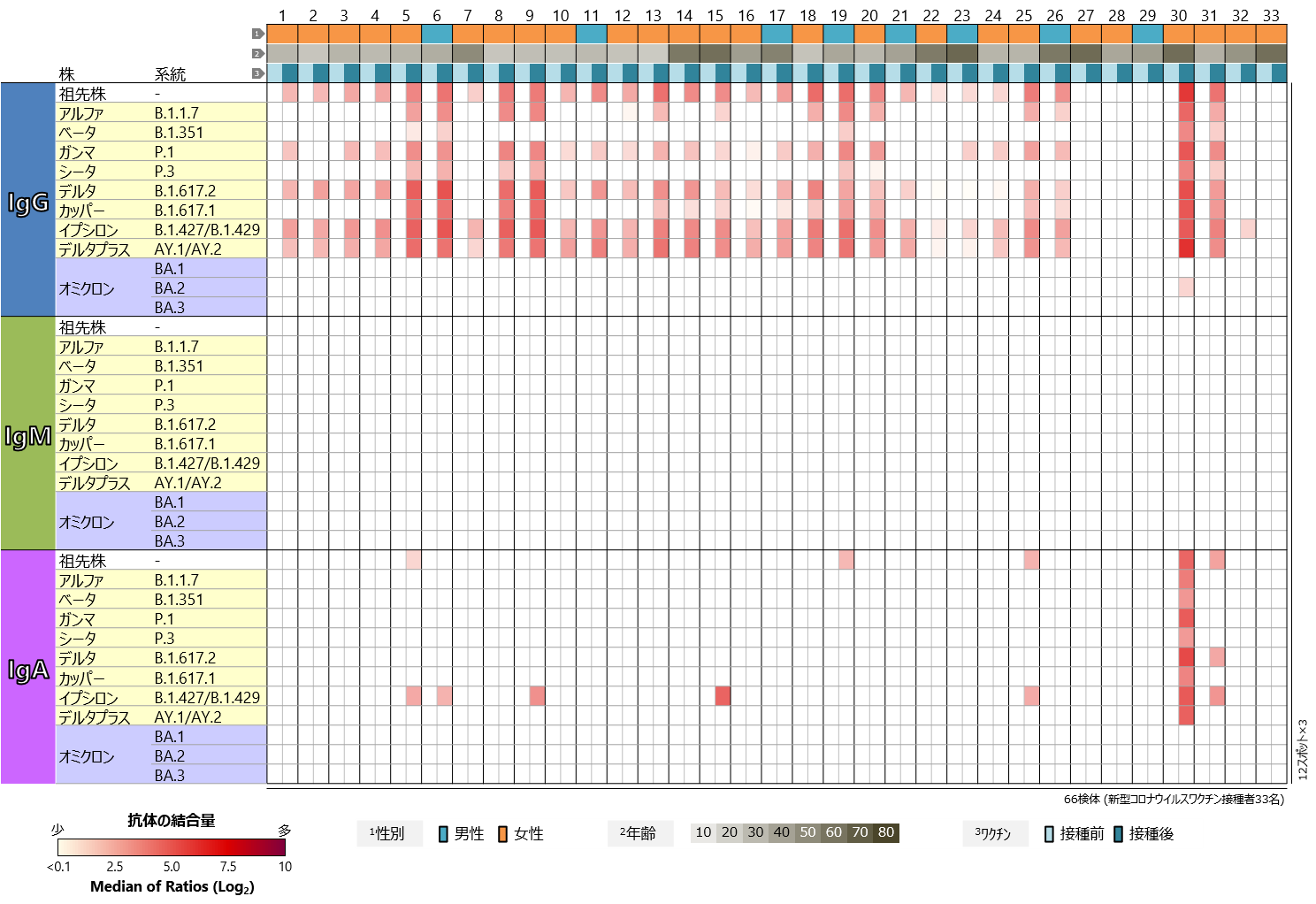
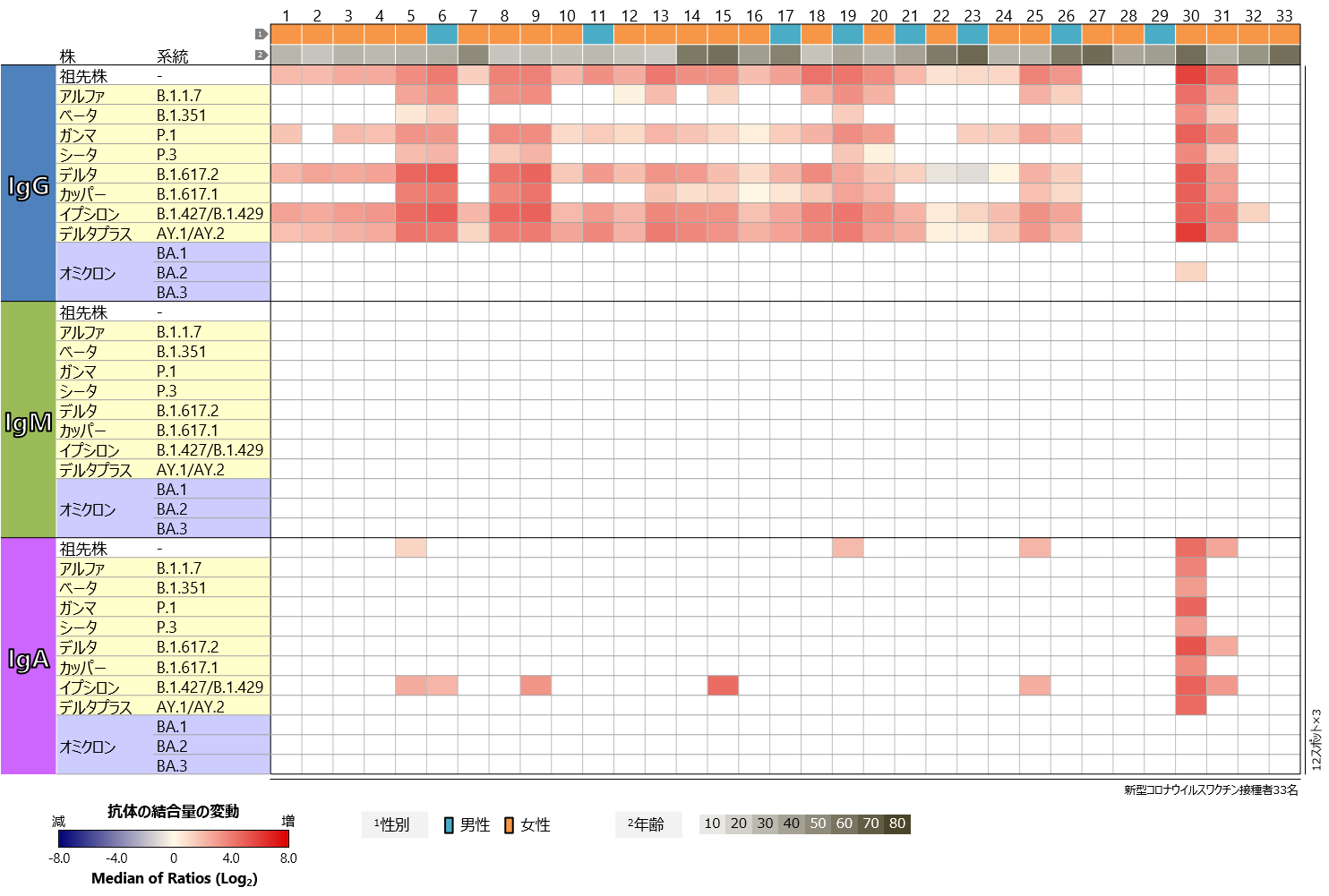
新型コロナウイルスについては、祖先株だけでなく、様々な変異株に対応したSタンパク質の試料が、福島事業のタンパク質マイクロアレイに搭載されています。それらに対する血中抗体プロファイルを、ワクチン接種前後で比較しました(図3)。IgGについて見てみると、一部の検体を除いて、祖先株にくわえてガンマ株(P.1系統)、デルタ株(B.1.617.2系統)、イプシロン株(B.1.427/B.1.429系統)、デルタプラス株(AY.1/AY.2系統)のRBDに対する反応の増強が認められ、アルファ株(B.1.1.7系統)、ベータ株(B.1.351系統)、シータ株(P.3系統)、カッパ株(B.1.617.1系統)のRBDに対する反応の増強も複数の検体で認められました。これらの変異株のRBDは、ワクチンの有効成分である祖先株のRBDと比べると、アミノ酸の違いは3か所以下で、複数の変異株で共通の変異が多く含まれます。一方、祖先株と15か所以上のアミノ酸が異なるオミクロン株のRBDに対しては、BA.1、BA.2、BA.3いずれの系統においても、IgG抗体の反応の増強はほぼすべての検体で認められませんでした。IgMの反応は、すべての症例でどの変異株に対しても検出されませんでした。IgAの反応もほとんど認められませんでしたが、オミクロン株のBA.2系統に対するIgGの反応が認められた1検体については、オミクロン株のRBDを除いて強い反応を検出しました。また、IgAの反応を検出したほかの検体では、祖先株との違いが1か所のみのイプシロン株のRBDへの反応が認められる傾向にありました。
図をクリックすると拡大表示します
図3 新型コロナウイルスワクチン接種者における
新型コロナウイルス主要変異株のRBDに対する血中抗体プロファイル
■ 解析数値データ(以下のボタンからダウンロードできます)
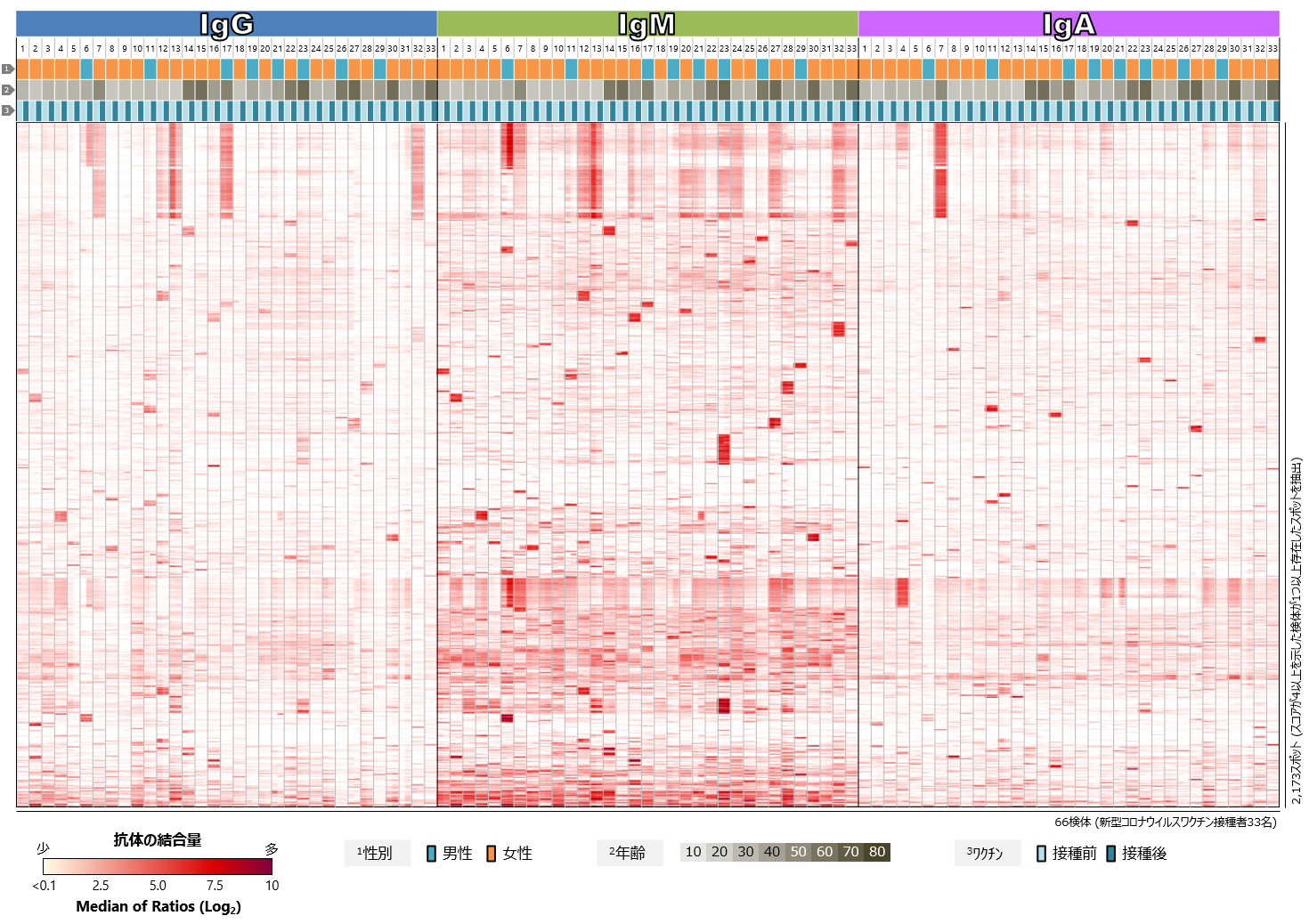
続いて、季節性コロナウイルスを含む様々な病原微生物や常在細菌、アレルゲンなど、いわゆる外来抗原群に対するワクチン接種前後の血中抗体プロファイルを比較しました(図4)。いずれの抗体クラス(IgG、IgM、IgA)においても、新型コロナウイルスSタンパク質以外の抗原に対して特徴的な抗体反応の変動は認められませんでした。
図をクリックすると拡大表示します
図4 新型コロナウイルスワクチン接種者における
外来抗原に対する血中抗体プロファイル
■ 解析数値データ(以下のボタンからダウンロードできます)
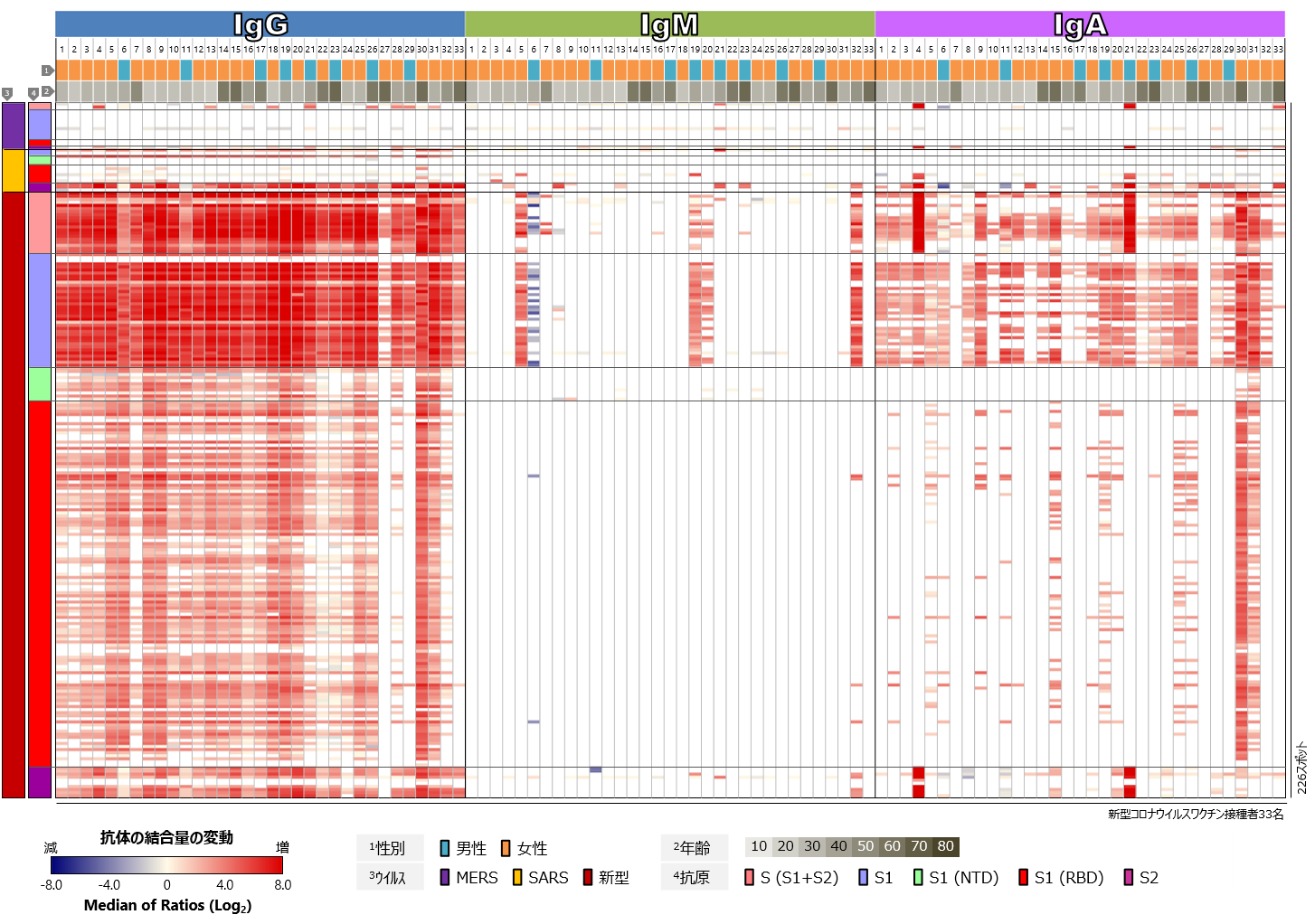
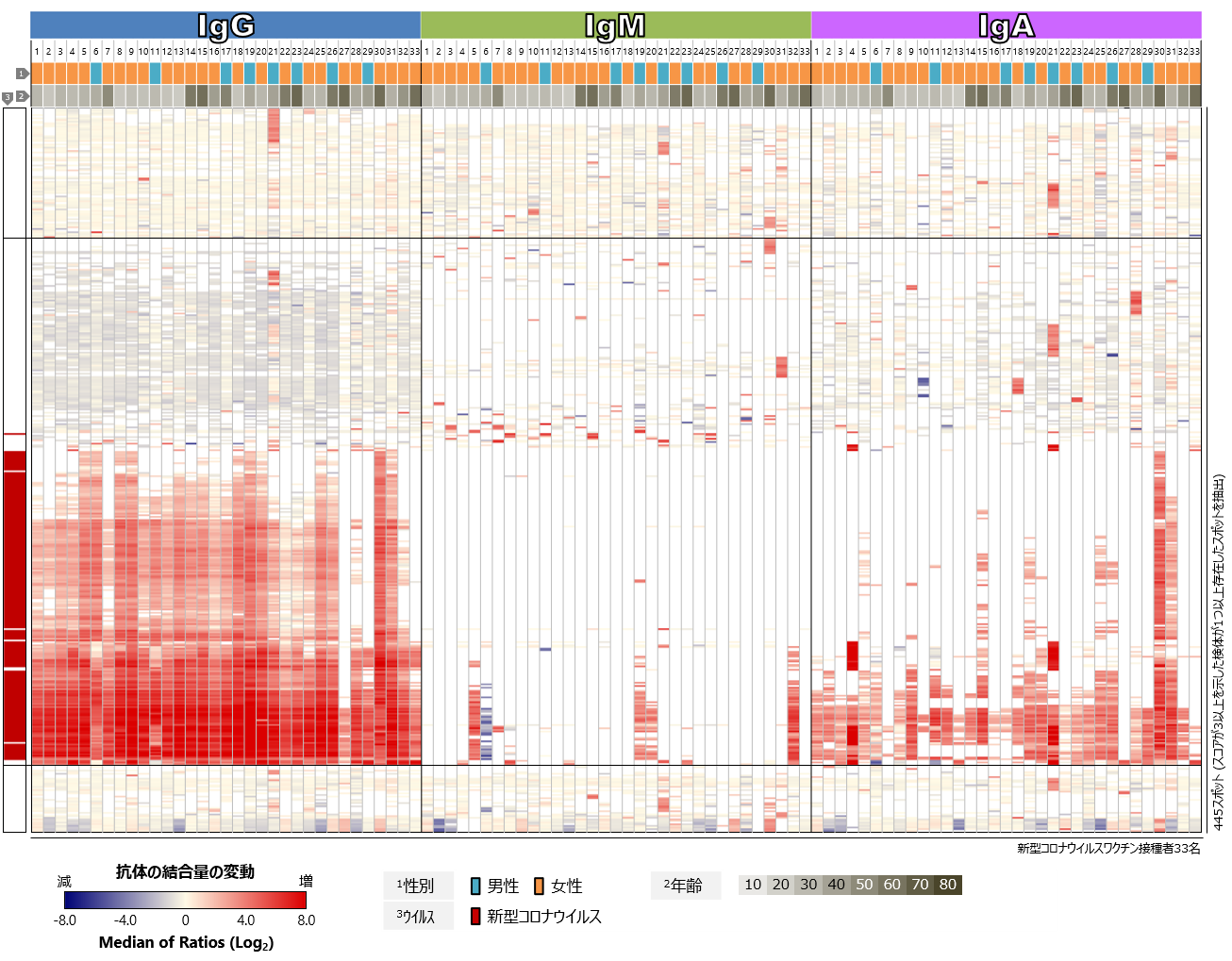
最後に、ヒトのタンパク質に対するワクチン接種前後の血中抗体プロファイル、すなわち自己抗体のプロファイルを比較しました(図5)。ワクチンの接種前後で、全体的なプロファイルに顕著な変化は認められませんでしたが、検体ごとには、特定のヒトタンパク質に対する自己抗体反応レベルの変化があることが分かりました。検体21番では多くのヒトタンパク質に対するワクチン接種後の自己抗体反応の増強が認められましたが、その多くはIgMの変化であり、接種後の採血日により近い時期、すなわちワクチン接種とは関係なくそれらの自己抗体の産生が誘導された可能性も考えられます。複数の検体に共通して顕著な変化を示した自己抗体反応は、今回解析した33名中には認められませんでした。
図をクリックすると拡大表示します
図5 新型コロナウイルスワクチン接種者における血中自己抗体プロファイル
■ 解析数値データ(以下のボタンからダウンロードできます)
今後の展開
COVID-19の重症化やロングCOVIDと呼ばれる感染回復後の慢性的な後遺症の原因として、自己免疫の関与が疑われています。ワクチン接種の場合も同様に、接種によって誘導される免疫応答において、ヒトタンパク質にも交差反応しうる抗体が産生されることが、接種後の副反応の一因となっている可能性が示唆されています。したがって、この交差反応を限りなく低いレベルに持っていくこと、すなわち、重要な抗原に対する自己抗体の産生を最低限に抑えることが、ワクチンの安全性に直結します。福島事業のタンパク質マイクロアレイシステムは、ワクチンの有効成分(今回のケースでは新型コロナウイルスのSタンパク質)に対する抗体の産生を評価できるだけでなく、さまざまな外来抗原や自己抗原に対する抗体の反応を、一網打尽に捉えることができます。ワクチン接種前後の比較にくわえ、ワクチン接種後における副反応発症の有無やワクチン接種者と自然感染者との違いなどを比較解析することで、ワクチンの有効性や安全性を評価するための、有用で客観的なデータの蓄積にも繋がると考えられます。COVID-19や毎年世界中で流行を繰り返すインフルエンザなどの既存感染症に限らず、将来的に起こりうる新興あるいは再興感染症にも応用が可能なシステムです。パンデミック対策においても、福島事業のタンパク質マイクロアレイシステムの活用が期待されます。
解説
(1) スパイクタンパク質
コロナウイルスの球形構造の表面に棘のように存在するタンパク質です。新型コロナウイルスにおいては、このスパイクタンパク質がヒトの細胞表面にあるACE2タンパク質に結合することが、ヒト細胞に感染する引き金となります。S1、S2という2つのサブユニットからなり、ACE2タンパク質との結合はS1サブユニット内の受容体結合領域(RBD: Receptor Binding Domain)が担っています。これまで承認された新型コロナウイルス感染症治療薬の多くは、RBDに結合することでウイルスの細胞への感染を阻害する中和抗体薬です。
(2) クラススイッチ
ヒトの免疫グロブリンには、IgG、IgM、IgA、IgD、IgEの5つのクラスが存在します。免疫応答によって活性化されたB細胞が最初に産生するのは、IgM型の免疫グロブリン(IgM抗体)です。その後、ヘルパーT細胞が産生するサイトカインと呼ばれる生理活性物質の作用によって、抗原との結合を担う多様性に富む部分(可変領域)の遺伝子を保持したまま、IgGやIgAなどほかのクラスへの遺伝子の組換えが起こり、IgMと同じエピトープを認識する別のクラスの抗体が産生されるようになります。この現象をクラススイッチといいます。
■ 資料(以下のボタンからダウンロードできます)
| タイトル | 形式 |
| 新型コロナウイルスワクチン接種者における血中抗体プロファイリング |